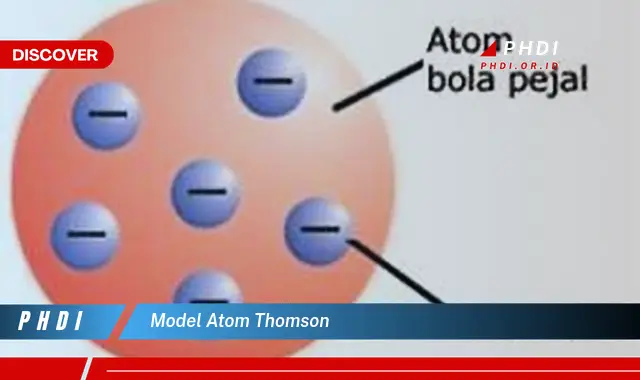
Model atom Thomson adalah model atom yang dikemukakan oleh Joseph John Thomson pada tahun 1904. Model ini menggambarkan atom sebagai bola bermuatan positif yang di dalamnya terdapat elektron yang tersebar seperti kismis dalam puding.
Model atom Thomson memiliki beberapa kelemahan, di antaranya:
- Tidak dapat menjelaskan hasil eksperimen hamburan sinar alfa oleh atom emas yang dilakukan oleh Ernest Rutherford.
- Tidak dapat menjelaskan fenomena garis spektrum atom.
Namun, model atom Thomson merupakan langkah awal yang penting dalam perkembangan pemahaman tentang struktur atom.
Model atom Thomson digantikan oleh model atom Rutherford pada tahun 1911.
Model Atom Thomson
Model atom Thomson adalah model atom yang dikemukakan oleh Joseph John Thomson pada tahun 1904. Model ini menggambarkan atom sebagai bola bermuatan positif yang di dalamnya terdapat elektron yang tersebar seperti kismis dalam puding.
- Bola bermuatan positif
- Elektron
- Tersebar
- Kismis dalam puding
- Eksperimen hamburan sinar alfa
- Garis spektrum atom
- Model atom Rutherford
Model atom Thomson merupakan langkah awal yang penting dalam perkembangan pemahaman tentang struktur atom. Namun, model ini memiliki beberapa kelemahan, sehingga digantikan oleh model atom Rutherford pada tahun 1911.
Bola bermuatan positif
Dalam model atom Thomson, bola bermuatan positif merupakan bagian penting karena merupakan tempat elektron berada. Elektron tersebar dalam bola bermuatan positif, seperti kismis dalam puding. Bola bermuatan positif ini juga berperan dalam menjaga kestabilan atom, karena muatan positifnya akan menarik muatan negatif elektron.
Elektron
Dalam model atom Thomson, elektron merupakan partikel bermuatan negatif yang tersebar dalam bola bermuatan positif. Elektron memiliki peran penting dalam menentukan sifat kimia suatu atom, karena jumlah elektron menentukan valensi atom tersebut. Elektron juga berperan dalam pembentukan ikatan kimia, sehingga menentukan jenis dan sifat senyawa kimia yang terbentuk.
Tersebar
Dalam model atom Thomson, elektron tidak berada pada posisi yang tetap, melainkan tersebar dalam bola bermuatan positif. Hal ini penting karena memungkinkan elektron untuk bergerak bebas dan membentuk ikatan kimia dengan atom lain. Jika elektron tidak tersebar, maka atom tidak akan dapat berinteraksi dengan atom lain dan membentuk senyawa kimia.
Kismis dalam Puding
Analogi “kismis dalam puding” digunakan dalam model atom Thomson untuk menggambarkan distribusi elektron dalam atom. Elektron tersebar secara acak dalam bola bermuatan positif, seperti kismis yang tersebar dalam puding.
-
Distribusi Elektron
Elektron dalam model atom Thomson tidak memiliki posisi yang tetap, melainkan tersebar secara acak dalam bola bermuatan positif. Hal ini berbeda dengan model atom Bohr yang menyatakan bahwa elektron bergerak pada orbit tertentu.
-
Muatan Listrik
Dalam model atom Thomson, bola bermuatan positif memiliki muatan yang sama dengan muatan negatif total elektron. Hal ini membuat atom menjadi netral secara keseluruhan.
-
Sifat Kimia
Distribusi elektron dalam atom menentukan sifat kimianya. Jumlah elektron pada kulit terluar menentukan valensi atom, yang menentukan jenis dan jumlah ikatan kimia yang dapat dibentuk.
-
Keterbatasan Model
Model atom Thomson tidak dapat menjelaskan beberapa fenomena, seperti garis spektrum atom dan hamburan sinar alfa. Hal ini mengarah pada pengembangan model atom yang lebih akurat, seperti model atom Rutherford dan model atom Bohr.
Meskipun memiliki keterbatasan, model atom Thomson merupakan langkah penting dalam perkembangan pemahaman tentang struktur atom. Model ini memperkenalkan konsep bahwa atom terdiri dari partikel subatomik dan memiliki muatan listrik.
Eksperimen Hamburan Sinar Alfa
Eksperimen hamburan sinar alfa merupakan eksperimen yang dilakukan oleh Ernest Rutherford pada tahun 1911. Eksperimen ini menjadi titik balik penting dalam perkembangan model atom, karena menunjukkan bahwa model atom Thomson tidak sesuai dengan hasil eksperimen.
-
Penemuan Inti Atom
Eksperimen hamburan sinar alfa menunjukkan bahwa sebagian besar massa atom terkonsentrasi pada bagian yang sangat kecil dan bermuatan positif, yang kemudian dikenal sebagai inti atom. Penemuan ini bertentangan dengan model atom Thomson yang menggambarkan atom sebagai bola bermuatan positif yang homogen.
-
Struktur Atom
Eksperimen hamburan sinar alfa juga memberikan informasi tentang struktur atom. Rutherford mengusulkan model atom yang baru, di mana elektron mengorbit inti atom pada lintasan tertentu. Model ini dikenal sebagai model atom Rutherford.
-
Teori Kuantum
Eksperimen hamburan sinar alfa memiliki implikasi penting bagi perkembangan teori kuantum. Model atom Rutherford tidak dapat menjelaskan secara lengkap perilaku elektron dalam atom. Hal ini mengarah pada pengembangan teori kuantum, yang memberikan penjelasan yang lebih akurat tentang struktur atom.
Eksperimen hamburan sinar alfa merupakan eksperimen penting yang merevolusi pemahaman kita tentang struktur atom. Eksperimen ini menunjukkan bahwa model atom Thomson tidak sesuai dengan kenyataan, dan mengarah pada pengembangan model atom yang lebih akurat, yaitu model atom Rutherford.
Garis Spektrum Atom
Garis spektrum atom merupakan pola garis-garis terang dan gelap yang dihasilkan ketika cahaya dari suatu unsur dilewatkan melalui prisma atau kisi difraksi. Pola garis-garis ini unik untuk setiap unsur dan dapat digunakan untuk mengidentifikasi unsur tersebut.
-
Asal-usul Garis Spektrum
Garis spektrum atom dihasilkan ketika elektron dalam atom tereksitasi ke tingkat energi yang lebih tinggi dan kemudian kembali ke tingkat energi yang lebih rendah. Ketika elektron kembali ke tingkat energi yang lebih rendah, ia memancarkan foton dengan energi yang sama dengan perbedaan energi antara kedua tingkat energi tersebut. Foton-foton inilah yang membentuk garis-garis pada spektrum atom.
-
Model Atom Thomson dan Garis Spektrum
Model atom Thomson tidak dapat menjelaskan garis spektrum atom. Model ini menggambarkan atom sebagai bola bermuatan positif yang homogen, yang tidak sesuai dengan kenyataan. Model atom Rutherford yang dikemukakan kemudian dapat menjelaskan garis spektrum atom dengan mengusulkan bahwa elektron bergerak pada lintasan tertentu mengelilingi inti atom.
-
Penerapan Garis Spektrum
Garis spektrum atom memiliki banyak aplikasi, di antaranya:
- Identifikasi unsur dalam suatu sampel
- Penentuan komposisi bintang dan galaksi
- Pengembangan laser dan lampu neon
-
Hubungan dengan Model Atom Thomson
Meskipun model atom Thomson tidak dapat menjelaskan garis spektrum atom, model ini merupakan langkah penting dalam perkembangan pemahaman tentang struktur atom. Model ini memperkenalkan konsep bahwa atom terdiri dari partikel subatomik dan memiliki muatan listrik.
Garis spektrum atom merupakan fenomena penting yang memberikan wawasan tentang struktur atom dan sifat unsur. Meskipun model atom Thomson tidak dapat menjelaskan garis spektrum atom, model ini memainkan peran penting dalam perkembangan pemahaman kita tentang atom.
Model Atom Rutherford
Model atom Rutherford merupakan pengembangan dari model atom Thomson. Model ini dikemukakan oleh Ernest Rutherford pada tahun 1911 berdasarkan hasil eksperimen hamburan sinar alfa. Model atom Rutherford memiliki beberapa perbedaan mendasar dengan model atom Thomson, antara lain:
-
Inti Atom
Model atom Rutherford menyatakan bahwa atom memiliki inti atom yang sangat kecil dan bermuatan positif. Inti atom ini merupakan pusat massa atom dan dikelilingi oleh elektron.
-
Elektron Mengorbit Inti
Model atom Rutherford menyatakan bahwa elektron bergerak mengorbit inti atom pada lintasan tertentu. Lintasan elektron ini disebut kulit elektron.
-
Muatan Inti dan Elektron
Model atom Rutherford menyatakan bahwa muatan inti atom adalah positif dan sama dengan jumlah proton dalam inti. Muatan elektron adalah negatif dan sama dengan muatan inti tetapi berlawanan tanda.
Model atom Rutherford merupakan kemajuan besar dalam pemahaman tentang struktur atom. Model ini dapat menjelaskan hasil eksperimen hamburan sinar alfa dan garis spektrum atom. Namun, model atom Rutherford masih memiliki beberapa keterbatasan, sehingga kemudian dikembangkan menjadi model atom Bohr.
Pertanyaan Umum tentang Model Atom Thomson
Model atom Thomson merupakan model awal struktur atom yang dikemukakan oleh J.J. Thomson pada tahun 1904. Model ini menggambarkan atom sebagai bola bermuatan positif yang di dalamnya terdapat elektron yang tersebar seperti kismis dalam puding.
Pertanyaan 1: Apa kelemahan model atom Thomson?
Model atom Thomson memiliki beberapa kelemahan, yaitu:
- Tidak dapat menjelaskan hasil eksperimen hamburan sinar alfa
- Tidak dapat menjelaskan fenomena garis spektrum atom
Pertanyaan 2: Apa perbedaan utama antara model atom Thomson dan model atom Rutherford?
Model atom Rutherford merupakan pengembangan dari model atom Thomson yang mengatasi kelemahan-kelemahannya. Perbedaan utama antara kedua model tersebut adalah:
- Model atom Rutherford memiliki inti atom yang kecil dan bermuatan positif, sedangkan model atom Thomson tidak.
- Elektron dalam model atom Rutherford bergerak mengorbit inti pada lintasan tertentu, sedangkan dalam model atom Thomson elektron tersebar dalam bola bermuatan positif.
Pertanyaan 3: Mengapa model atom Thomson penting dalam perkembangan fisika atom?
Meskipun memiliki kelemahan, model atom Thomson merupakan langkah penting dalam perkembangan fisika atom. Model ini memperkenalkan konsep bahwa atom tersusun dari partikel-partikel subatomik dan memiliki muatan listrik.
Pertanyaan 4: Apa saja penerapan dari pemahaman tentang model atom Thomson?
Pemahaman tentang model atom Thomson telah diterapkan dalam berbagai bidang, seperti:
- Pengembangan tabung sinar katode
- Pengembangan spektroskopi
- Pengembangan teori kuantum
Model atom Thomson merupakan bagian penting dari sejarah fisika atom dan menjadi dasar bagi pengembangan model atom yang lebih akurat di kemudian hari.
Lanjut ke bagian selanjutnya: Model Atom Rutherford
Tips Memahami Model Atom Thomson
Model atom Thomson merupakan model awal struktur atom yang dikemukakan oleh J.J. Thomson pada tahun 1904. Berikut adalah beberapa tips untuk memahami model atom Thomson:
Tip 1: Pahami Konsep Dasar
Model atom Thomson menggambarkan atom sebagai bola bermuatan positif yang di dalamnya terdapat elektron yang tersebar seperti kismis dalam puding. Konsep dasar ini penting untuk dipahami sebagai dasar untuk memahami detail model atom Thomson.
Tip 2: Perhatikan Kelebihan dan Kekurangan
Model atom Thomson memiliki kelebihan dan kekurangan. Kelebihannya adalah model ini memperkenalkan konsep bahwa atom tersusun dari partikel-partikel subatomik dan memiliki muatan listrik. Kekurangannya adalah model ini tidak dapat menjelaskan hasil eksperimen hamburan sinar alfa dan fenomena garis spektrum atom.
Tip 3: Bandingkan dengan Model Atom Lainnya
Untuk lebih memahami model atom Thomson, bandingkan model ini dengan model atom lainnya, seperti model atom Rutherford dan model atom Bohr. Perbandingan ini akan membantu mengidentifikasi perbedaan dan persamaan antara model-model atom tersebut.
Tip 4: Cari Contoh dan Aplikasi
Untuk memperkuat pemahaman, carilah contoh dan aplikasi dari model atom Thomson. Misalnya, model ini digunakan dalam pengembangan tabung sinar katode dan spektroskopi. Memahami aplikasi praktis akan membantu memperjelas konsep model atom Thomson.
Tip 5: Konsultasikan dengan Sumber yang Reputable
Jika mengalami kesulitan memahami model atom Thomson, konsultasikan dengan sumber yang reputable, seperti buku teks, jurnal ilmiah, atau pengajar. Sumber-sumber ini dapat memberikan penjelasan yang lebih rinci dan membantu menjawab pertanyaan yang mungkin muncul.
Dengan mengikuti tips ini, Anda dapat memperoleh pemahaman yang lebih baik tentang model atom Thomson dan perannya dalam perkembangan fisika atom.
Lanjut ke bagian selanjutnya:
Youtube Video: