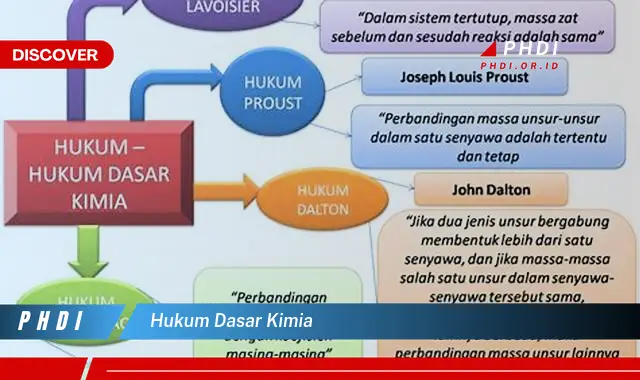
Hukum dasar kimia adalah prinsip-prinsip dasar yang mendasari sifat dan perilaku materi. Hukum-hukum ini menjelaskan bagaimana atom dan molekul berinteraksi satu sama lain, dan bagaimana mereka membentuk zat baru. Beberapa hukum dasar kimia yang paling penting meliputi hukum kekekalan massa, hukum komposisi tetap, dan hukum perbandingan berganda.
Hukum dasar kimia sangat penting untuk memahami kimia dan untuk memprediksi perilaku materi. Mereka digunakan dalam berbagai aplikasi, termasuk pengembangan obat-obatan baru, desain material baru, dan pemahaman proses lingkungan. Hukum-hukum ini juga penting untuk memahami sejarah kimia, karena mereka membentuk dasar untuk banyak penemuan dan teori kimia.
Hukum dasar kimia pertama kali dirumuskan oleh para ilmuwan pada akhir abad ke-18 dan awal abad ke-19. Seiring waktu, hukum-hukum ini telah disempurnakan dan diperluas untuk mencakup pemahaman kita yang lebih baik tentang materi. Hukum-hukum ini terus menjadi landasan kimia, dan mereka akan terus memainkan peran penting dalam pengembangan bidang ini di masa depan.
Hukum Dasar Kimia
Hukum dasar kimia adalah prinsip-prinsip dasar yang mengatur sifat dan perilaku materi. Hukum-hukum ini penting untuk memahami kimia dan memprediksi perilaku materi. Berbagai dimensinya meliputi:
- Kekekalan Massa
- Komposisi Tetap
- Perbandingan Berganda
- Volume Gas
- Tekanan Gas
- Laju Reaksi
- Kesetimbangan Kimia
Hukum-hukum ini saling terkait dan membentuk dasar untuk memahami bagaimana materi berperilaku. Misalnya, hukum kekekalan massa menyatakan bahwa massa zat tidak berubah selama reaksi kimia. Hukum komposisi tetap menyatakan bahwa suatu senyawa selalu memiliki komposisi unsur yang sama, terlepas dari bagaimana senyawa itu dibuat. Hukum-hukum ini memungkinkan para ilmuwan untuk memprediksi hasil reaksi kimia dan merancang eksperimen kimia.
Kekekalan Massa
Kekekalan massa adalah salah satu hukum dasar kimia yang menyatakan bahwa massa zat tidak berubah selama reaksi kimia. Artinya, massa reaktan sama dengan massa produk. Hukum ini sangat penting karena memungkinkan para ilmuwan untuk memprediksi hasil reaksi kimia dan untuk menyeimbangkan persamaan reaksi kimia.
Kekekalan massa merupakan salah satu prinsip dasar kimia dan fisika. Prinsip ini pertama kali dikemukakan oleh Antoine Lavoisier pada tahun 1789. Lavoisier melakukan serangkaian percobaan yang menunjukkan bahwa massa zat tidak berubah selama reaksi kimia. Percobaan-percobaan ini sangat penting karena men teori sebelumnya yang menyatakan bahwa massa dapat diciptakan atau dimusnahkan selama reaksi kimia.
Kekekalan massa adalah hukum dasar kimia yang sangat penting. Hukum ini memungkinkan para ilmuwan untuk memahami dan memprediksi perilaku materi selama reaksi kimia. Hukum ini juga digunakan dalam berbagai aplikasi, seperti pengembangan obat-obatan baru, desain material baru, dan pemahaman proses lingkungan.
Komposisi Tetap
Hukum komposisi tetap menyatakan bahwa suatu senyawa selalu memiliki komposisi unsur yang sama, terlepas dari bagaimana senyawa itu dibuat. Artinya, perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap. Hukum ini sangat penting karena memungkinkan para ilmuwan untuk memprediksi komposisi senyawa dan untuk mengidentifikasi senyawa yang tidak diketahui.
-
Contoh
Air selalu terdiri dari dua atom hidrogen dan satu atom oksigen, terlepas dari sumber airnya. Garam dapur selalu terdiri dari satu atom natrium dan satu atom klorin, terlepas dari bagaimana garam itu dibuat. -
Aplikasi
Hukum komposisi tetap digunakan dalam berbagai aplikasi, seperti:- Identifikasi senyawa yang tidak diketahui
- Pengembangan obat-obatan baru
- Desain material baru
-
Implikasi
Hukum komposisi tetap memiliki implikasi penting untuk pemahaman kita tentang materi. Hukum ini menunjukkan bahwa materi terdiri dari unsur-unsur yang berbeda, yang dapat bergabung dalam proporsi yang tetap untuk membentuk senyawa. Hukum ini juga menunjukkan bahwa sifat suatu senyawa ditentukan oleh komposisi unsurnya.
Hukum komposisi tetap merupakan salah satu hukum dasar kimia yang paling penting. Hukum ini memberikan dasar untuk pemahaman kita tentang materi dan sifat-sifatnya.
Perbandingan Berganda
Hukum perbandingan berganda menyatakan bahwa jika dua unsur membentuk lebih dari satu senyawa, massa salah satu unsur yang bergabung dengan massa tetap unsur lainnya akan memiliki perbandingan bilangan bulat sederhana.
Hukum ini penting karena memungkinkan para ilmuwan untuk menentukan rumus kimia senyawa yang berbeda yang dibentuk oleh unsur yang sama. Misalnya, karbon dan oksigen membentuk dua senyawa, yaitu karbon monoksida (CO) dan karbon dioksida (CO2). Massa oksigen yang bergabung dengan massa tetap karbon dalam karbon monoksida adalah 16, sedangkan massa oksigen yang bergabung dengan massa tetap karbon dalam karbon dioksida adalah 32. Perbandingan ini adalah 1:2, yang merupakan bilangan bulat sederhana.
Hukum perbandingan berganda merupakan salah satu hukum dasar kimia yang penting. Hukum ini memungkinkan para ilmuwan untuk memahami hubungan antara massa unsur-unsur dalam suatu senyawa dan untuk menentukan rumus kimia senyawa.
Volume Gas
Volume gas merupakan salah satu sifat penting gas yang dipelajari dalam hukum dasar kimia. Hukum-hukum ini menjelaskan bagaimana volume gas berubah ketika tekanan, suhu, dan jumlah gas berubah. Berikut adalah beberapa aspek penting hubungan antara volume gas dan hukum dasar kimia:
-
Hukum Boyle
Hukum Boyle menyatakan bahwa pada suhu tetap, volume gas berbanding terbalik dengan tekanannya. Artinya, jika tekanan gas dinaikkan, volumenya akan berkurang. Sebaliknya, jika tekanan gas diturunkan, volumenya akan meningkat. -
Hukum Charles
Hukum Charles menyatakan bahwa pada tekanan tetap, volume gas berbanding lurus dengan suhunya. Artinya, jika suhu gas dinaikkan, volumenya akan meningkat. Sebaliknya, jika suhu gas diturunkan, volumenya akan berkurang. -
Hukum Gay-Lussac
Hukum Gay-Lussac menyatakan bahwa pada volume tetap, tekanan gas berbanding lurus dengan suhunya. Artinya, jika suhu gas dinaikkan, tekanannya akan meningkat. Sebaliknya, jika suhu gas diturunkan, tekanannya akan berkurang. -
Persamaan Gas Ideal
Persamaan gas ideal menggabungkan hukum Boyle, Charles, dan Gay-Lussac menjadi satu persamaan yang komprehensif. Persamaan ini menyatakan bahwa PV = nRT, di mana P adalah tekanan, V adalah volume, n adalah jumlah mol gas, R adalah konstanta gas, dan T adalah suhu.
Hukum-hukum ini sangat penting untuk memahami sifat gas dan untuk memprediksi perilaku gas dalam berbagai kondisi. Hukum-hukum ini digunakan dalam berbagai aplikasi, seperti perancangan sistem penyimpanan gas, pengembangan mesin pembakaran internal, dan pemahaman proses atmosfer.
Tekanan Gas
Tekanan gas berperan penting dalam hukum dasar kimia, terutama dalam hukum Boyle. Hukum Boyle menyatakan bahwa pada suhu tetap, volume gas berbanding terbalik dengan tekanannya. Artinya, jika tekanan gas dinaikkan, volumenya akan berkurang. Sebaliknya, jika tekanan gas diturunkan, volumenya akan meningkat.
Keterkaitan antara tekanan gas dan hukum dasar kimia sangat penting karena memungkinkan kita untuk memprediksi perilaku gas dalam berbagai kondisi. Misalnya, hukum Boyle dapat digunakan untuk merancang sistem penyimpanan gas, seperti tabung gas dan tangki bahan bakar. Hukum ini juga digunakan dalam pengembangan mesin pembakaran internal, seperti mesin mobil dan pesawat terbang.
Selain hukum Boyle, tekanan gas juga berperan dalam hukum-hukum dasar kimia lainnya, seperti hukum Charles dan hukum Gay-Lussac. Hukum Charles menyatakan bahwa pada tekanan tetap, volume gas berbanding lurus dengan suhunya. Hukum Gay-Lussac menyatakan bahwa pada volume tetap, tekanan gas berbanding lurus dengan suhunya.
Tekanan gas merupakan salah satu sifat penting gas yang perlu dipertimbangkan dalam berbagai aplikasi kimia. Pemahaman tentang hubungan antara tekanan gas dan hukum dasar kimia sangat penting untuk merancang sistem dan proses yang melibatkan gas.
Laju Reaksi
Laju reaksi merupakan salah satu aspek penting dalam hukum dasar kimia. Laju reaksi mengacu pada seberapa cepat suatu reaksi kimia berlangsung. Pemahaman tentang laju reaksi sangat penting untuk merancang dan mengoptimalkan proses kimia, serta untuk memprediksi perilaku sistem kimia.
-
Faktor yang Mempengaruhi Laju Reaksi
Laju reaksi dipengaruhi oleh beberapa faktor, antara lain konsentrasi reaktan, suhu, luas permukaan, dan katalis. Konsentrasi reaktan yang lebih tinggi, suhu yang lebih tinggi, luas permukaan yang lebih besar, dan katalis yang efektif dapat mempercepat laju reaksi.
-
Hukum Laju Reaksi
Hukum laju reaksi adalah persamaan matematika yang menggambarkan hubungan antara laju reaksi dan konsentrasi reaktan. Hukum laju reaksi dapat digunakan untuk memprediksi laju reaksi pada kondisi tertentu.
-
Aplikasi Laju Reaksi
Pemahaman tentang laju reaksi memiliki berbagai aplikasi dalam kehidupan nyata, seperti dalam pengembangan obat-obatan baru, desain material baru, dan optimalisasi proses industri.
Laju reaksi merupakan aspek penting dalam hukum dasar kimia yang memungkinkan kita untuk memahami dan memprediksi perilaku sistem kimia. Pemahaman tentang laju reaksi sangat penting untuk berbagai aplikasi, mulai dari pengembangan obat-obatan hingga optimalisasi proses industri.
Kesetimbangan Kimia
Kesetimbangan kimia merupakan salah satu konsep dasar dalam kimia yang menjelaskan tentang keadaan suatu reaksi kimia ketika laju reaksi maju sama dengan laju reaksi balik. Pada kondisi kesetimbangan, konsentrasi reaktan dan produk tetap konstan seiring berjalannya waktu.
-
Posisi Kesetimbangan
Posisi kesetimbangan suatu reaksi dipengaruhi oleh beberapa faktor, seperti suhu, tekanan, dan konsentrasi awal reaktan. Perubahan kondisi ini dapat menggeser posisi kesetimbangan ke arah reaktan atau produk. -
Konstanta Kesetimbangan
Setiap reaksi kesetimbangan memiliki konstanta kesetimbangan yang merupakan nilai tetap pada suhu tertentu. Konstanta kesetimbangan dapat digunakan untuk memprediksi komposisi campuran pada keadaan kesetimbangan. -
Aplikasi Kesetimbangan Kimia
Konsep kesetimbangan kimia memiliki berbagai aplikasi dalam kehidupan nyata, antara lain:- Pembuatan amonia dalam industri pupuk
- Proses Haber dalam sintesis senyawa organik
- Pengendalian polusi udara melalui reaksi katalitik
Kesetimbangan kimia merupakan konsep penting dalam hukum dasar kimia yang memungkinkan kita memahami dan memprediksi perilaku reaksi kimia. Pemahaman tentang kesetimbangan kimia sangat penting untuk berbagai aplikasi, mulai dari pengembangan proses industri hingga pengendalian polusi lingkungan.
Pertanyaan Umum tentang Hukum Dasar Kimia
Berikut adalah beberapa pertanyaan umum tentang hukum dasar kimia beserta jawabannya:
Pertanyaan 1: Apa saja hukum dasar kimia yang penting?
Jawaban: Hukum dasar kimia yang penting meliputi hukum kekekalan massa, hukum komposisi tetap, hukum perbandingan berganda, hukum volume gas, hukum tekanan gas, hukum laju reaksi, dan hukum kesetimbangan kimia.
Pertanyaan 2: Mengapa hukum dasar kimia itu penting?
Jawaban: Hukum dasar kimia penting karena memungkinkan kita untuk memahami dan memprediksi perilaku materi dan reaksi kimia. Hukum-hukum ini digunakan dalam berbagai aplikasi, seperti pengembangan obat-obatan baru, desain material baru, dan pemahaman proses lingkungan.
Pertanyaan 3: Apa saja aplikasi hukum dasar kimia dalam kehidupan sehari-hari?
Jawaban: Hukum dasar kimia memiliki berbagai aplikasi dalam kehidupan sehari-hari, seperti dalam pembuatan makanan, obat-obatan, dan bahan bakar. Hukum-hukum ini juga digunakan dalam pengendalian polusi lingkungan dan pengembangan teknologi baru.
Pertanyaan 4: Bagaimana hukum dasar kimia dapat membantu kita memahami dunia di sekitar kita?
Jawaban: Hukum dasar kimia dapat membantu kita memahami sifat materi, perubahan kimia, dan proses-proses yang terjadi di alam. Hukum-hukum ini memberikan dasar untuk banyak teknologi modern dan membantu kita memahami bagaimana dunia di sekitar kita bekerja.
Dengan memahami hukum dasar kimia, kita dapat memperoleh pemahaman yang lebih baik tentang dunia di sekitar kita dan menggunakan pengetahuan ini untuk memecahkan masalah dan mengembangkan teknologi baru.
Lanjut ke bagian selanjutnya: Aplikasi Hukum Dasar Kimia
Tips Menguasai Hukum Dasar Kimia
Hukum dasar kimia sangat penting untuk dipahami dalam mempelajari kimia. Hukum-hukum ini memberikan dasar untuk memahami sifat materi dan reaksi kimia. Berikut adalah beberapa tips untuk membantu Anda menguasai hukum dasar kimia:
Tip 1: Pahami Konsep Dasar
Sebelum mempelajari hukum dasar kimia, pastikan Anda memahami konsep dasar kimia, seperti struktur atom, ikatan kimia, dan reaksi kimia. Hal ini akan mempermudah Anda untuk memahami hukum-hukum dasar kimia.
Tip 2: Pelajari Satu Persatu
Jangan mencoba mempelajari semua hukum dasar kimia sekaligus. Pelajarilah satu per satu secara bertahap. Pahami setiap hukum dengan baik sebelum melanjutkan ke hukum berikutnya.
Tip 3: Gunakan Contoh dan Soal Latihan
Untuk memperkuat pemahaman Anda tentang hukum dasar kimia, gunakan contoh dan soal latihan. Carilah contoh-contoh nyata dari penerapan hukum-hukum ini dan kerjakan soal latihan untuk menguji pemahaman Anda.
Tip 4: Diskusikan dengan Teman atau Guru
Diskusikan hukum dasar kimia dengan teman atau guru Anda. Bertukar pikiran dan saling bertanya dapat membantu Anda memperjelas pemahaman Anda dan mengidentifikasi area yang perlu diperbaiki.
Tip 5: Uji Pemahaman Anda Secara Berkala
Setelah mempelajari hukum dasar kimia, uji pemahaman Anda secara berkala. Kerjakan soal-soal latihan atau ikuti kuis untuk mengidentifikasi kelemahan Anda dan memperkuat pemahaman Anda.
Kesimpulan
Dengan mengikuti tips-tips di atas, Anda dapat menguasai hukum dasar kimia dan memperoleh pemahaman yang kuat tentang sifat materi dan reaksi kimia. Pemahaman ini akan menjadi dasar yang kokoh untuk studi kimia lebih lanjut dan aplikasi praktisnya.
Youtube Video: